Версия для слабовидящих
-
1. АНАЛИТИЧЕСКАЯ ХИМИЯ
- 1.1. Аналитическая химия, её задачи и значение. Методы количественного и качественного анализа.
- 1.2. Закон действия масс. Классификация катионов. Первая аналитическая группа катионов. Гидролиз солей
- 1.3 Классификация анионов
- 1.4 Окислительно- восстановительные реакции. Амфотерность. Третья аналитическая группа катионов
- 1.5. Самостоятельная работа
- 1.6. Практическая работа
- 1.7. Тест
-
2. ОРГАНИЧЕСКАЯ ХИМИЯ
- 2.1. Основные теоретические положения органической химии
- 2.2. Насыщенные (предельные) ациклические соединения.
- 2.3. Номенклатура насыщенных углеводородов
- 2.4. Ароматические углеводороды (арены)
- 2.5. Одно и многоатомные спирты. Простые эфиры.
- 2.6. Самостоятельная работа
- 2.7. Практическая работа
- 2.8 Тест
- 3. ФИЗИЧЕСКАЯ ХИМИЯ
-
4. ОПРЕДЕЛЕНИЕ ОПТИМАЛЬНЫХ СРЕДСТВ И МЕТОДОВ АНАЛИЗА ПРИРОДНЫХ И ПРОМЫШЛЕННЫХ МАТЕРИАЛОВ.
- 4.1. Иерархическая организация и критерии оценки эффективности химико-технологических производств
- 4.2. Основные законы общей химии. Стехиометрия. Химический эквивалент.
- 4.3. Гравиметрический метод анализа
- 4.4. Метод осаждения
- 4.5. Взвешивание (взятие навески)
- 4.6. Промышленный катализ
- 4.7. Химические ректоры
- 4.8. Электрохимические методы анализа, их классификация. Основные характеристики
- 4.10. Самостоятельная работа
- 4.9. Практическая работа
- 4.10. Тест
- 5. ОСНОВЫ КАЧЕСТВЕННОГО И КОЛИЧЕСТВЕННОГО АНАЛИЗА
-
6. СПЕКТРАЛЬНЫЙ АНАЛИЗ
- 6.1. Спектральный анализ периодических сигналов.
- 6.2. Методы спектрального анализа и их применение в экспертных исследованиях
- 6.3. Классификация сигналов
- 6.4. Схема проведения анализа
- 6.5. Назначение спектрального анализа периодических сигналов.
- 6.6. Спектральный анализ периодических сигналов на основе тригонометрических рядов Фурье
- 6.7. Практическая работа
- 7. МЕТОДЫ АТОМНО-ЭМИССИОННОГО СПЕКТРАЛЬНОГО АНАЛИЗА
- 8. МЕТРОЛОГИЯ, СТАНДАРТИЗАЦИЯ И СЕРТИФИКАЦИЯ
- 9. ОРГАНИЗАЦИЯ ЛАБОРАТОРНО - ПРОИЗВОДСТВЕННОЙ ДЕЯТЕЛЬНОСТИ
- ИТОГОВЫЙ МЕЖДИСЦИПЛИНАРНЫЙ ЭКЗАМЕН
1.1. Аналитическая химия, её задачи и значение. Методы количественного и качественного анализа.
Аналитическая химия – раздел химической науки, теоретически обосновывает методы качественного и количественного анализа, с помощью которых можно судить о качественном составе вещества и устанавливать количественные соотношения элементов и химических соединений данного вещества; является базой для технохимического контроля на предприятиях общественного питания.
Анализ вещества, т.е. определение химического состава вещества (или смесей веществ) проводят методами качественного и количественного исследования. Методами аналитической химии определяют качество сырья, полуфабрикатов, готовой продукции, норм вложения сырья и т.д., что позволяет наиболее рационально использовать сырье, предупреждать возникновение брака и получать продукцию наилучшего качества.
Задачей качественного анализа является выяснение качественного состава вещества, т. е. из каких элементов или ионов состоит данное вещество.
Методы качественного анализа по способу исследования делятся на химические, физико-химические и физические.
Физические методы основаны на изучении физических свойств анализируемого вещества. К этим методам относятся спектральный, рентгеноструктурный, масс- спектрометрический анализы и др. В физико-химических методах течение реакции фиксируется измерением определенного физического свойства исследуемого раствора. К этим методам относятся полярография, хроматография и др. К химическим методам относятся методы, основанные на использовании химических свойств исследуемых веществ.
Реакции химических методов могут проводиться «сухим» и «мокрым» путем.
Анализ сухим путем – химические реакции, происходящие при накаливании, сплавлении и окрашивании.
Анализ мокрым путем – химические реакции, происходящие в растворах электролитов.
Методы качественного и количественного анализа в зависимости от количества анализируемого вещества делят на: макрометод (1-2 мл раствора или 0,1 гр. вещества); полу-микрометод (0,05-0,1 мл раствора или 0,1 гр. вещества); микрометод (1-2 капли раствора или 0,001 гр. вещества).
Аналитическая реакция – химический процесс, направленный на определение исследуемых веществ на наличие заданных частиц.
Признаками аналитической реакции являются: выпадение или растворение осадка, изменение цвета раствора, выделение газообразного вещества, изменение окраски индикатора. При проведении аналитической реакции необходимо придерживаться определенных условий: концентрации реагирующих веществ, реакции среды, температуры. Специфическими называют аналитические реакции, аналитический эффект которых характерен только для одного иона в присутствии других ионов.
Ионы аммония, к примеру, можно обнаружить в смеси ионов, действуя на анализируемые образцы избытком раствора щелочи:
NH4Cl + KOH = NH3^ + KCl + H2O.
Выделяющийся аммиак легко обнаружить по изменению цвета индикаторной бумаги или органолептически (по запаху).
Чувствительная реакция – реакция, при помощи которой можно открыть наименьшее количество вещества или иона из наименьшего объема раствора.
При помощи специфических реакций можно открывать соответствующие ионы непосредственно в отдельных порциях исследуемого вещества. Такой способ называют «дробным».
Систематический ход анализа — это определенная последовательность выполнения аналитических реакций, при которой каждый ион обнаруживают после того, как будут обнаружены и удалены мешающие ионы.
Теория электролитической диссоциации.
Растворы всех веществ можно разделить на две группы: электролиты- проводят электрический ток, не электролиты- проводниками не являются. Это деление является условным, потому что все растворы веществ проводят электрический ток, все они в той или иной мере растворяются в воде и распадаются на катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы). Диссоциация кислот, оснований и солей в водных растворах.
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода. Например:

Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. Например:
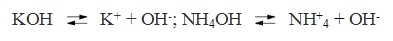
Солями называются электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония (NH+ 4) и анионы кислотных остатков. Например:
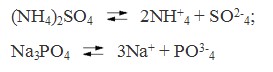
Так диссоциируют средние соли. Кислые же и основные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. Например:
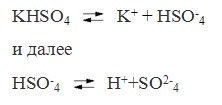
У основных солей вначале отщепляются кислотные остатки, а затем гидроксидионы.
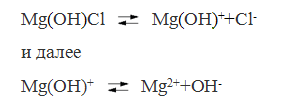
Различают сильные и слабые электролиты. Сильные электролиты при растворении в воде диссоциируют на ионы.
1) почти все соли;
2) многие минеральные кислоты, например Н2SO4, HNO3, НСl, HBr, HI, НМnО4, НСlО3, НСlО4;
3) основания щелочных и щелочноземельных металлов.
Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы. К ним относятся:
1) почти все органические кислоты;
2) некоторые минеральные кислоты, например H2СО3, Н2S, НNO2, HClO, H2SiO3;
3) многие основания металлов (кроме оснований щелочных и щёлочноземельных металлов), а также NH4OH, который можно изображать как гидрат аммиака NH3•H2O.
К слабым электролитам относится вода.
Слабые электролиты не могут дать большой концентрации ионов в растворе.
Качественный анализ.
С помощью групповых реактивов (определенных химических веществ) из общей смеси катионов можно выделить отдельные группы катионов со сходными аналитическими свойствами – аналитические группы.
При систематическом анализе принято деление катионов и анионов на аналитические группы. В настоящее время принята классификация катионов, разработанная Н.А. Меншуткиным в 1871 г. Все существующие ныне классификации предусматривают разделение катионов на 5 или 6 аналитических групп на основании следующих их свойств:
1. На различии растворимости хлоридов, карбонатов, сульфатов или гидроксидов.
2. На амфотерных свойствах некоторых гидроксидов.
3. На способности ряда гидроксидов образовывать комплексные аммиакаты.
